Dynamische Anpassung der Elastizität des Titinfilaments
Die Elastizität, bzw. passive Steifigkeit der Muskulatur kann variabel an die vorherrschenden Bedingungen angepasst werden. Die Modulation der Elastizität erfolgt zum Großteil über das Verhältnis verschiedener Titin-Isoformen.
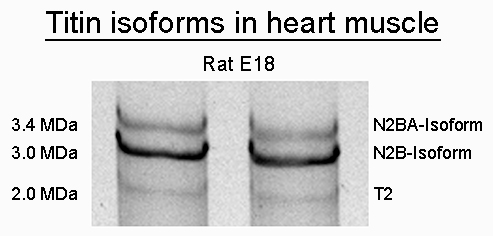 Ein einzelnes Gen codiert die gesamte Aminosäuresequenz von Titin. Entwicklungs- und muskelspezifisch kommt eine Vielzahl von Titin-Isoformen vor. Diese entstehen durch alternatives Spleißen der Titin-prä-mRNA. Im Skelettmuskel werden Isoformen vom N2A-Typ (3,3-3,7 MDa), im Herzmuskel mehrere Isoformen vom N2BA-Typ (3,2-3,7 MDa) sowie eine steife und kurze Isoform N2B (3,0 MDa) ko-exprimiert. Das Verhältnis dieser Isoformen bestimmt zu einem großen Teil die elastischen Eigenschaften des Titinfilaments. Während der Embryonalentwicklung ändert sich das Verhältnis der verschiedenen Isoformen. Es findet eine verstärkte Expression kürzerer und somit steiferer Isoformen statt. Als Folge daraus sinkt die Elastizität des Titinfilaments. Doch welche Faktoren sind es, die diesen Isoformenswitch beeinflussen? Embryonale Rattenkardiomyozyten dienen uns zur Beantwortung dieser Frage als Zellkulturmodell. Nach hormoneller, bzw. medikamentöser Behandlung der Zellen vergleichen wir diese mit unbehandelten Kontrollzellen. So können wir Rückschlüsse auf die beteiligten Signalwege ziehen und die Regulation des Isoformenswitch näher beleuchten.
Ein einzelnes Gen codiert die gesamte Aminosäuresequenz von Titin. Entwicklungs- und muskelspezifisch kommt eine Vielzahl von Titin-Isoformen vor. Diese entstehen durch alternatives Spleißen der Titin-prä-mRNA. Im Skelettmuskel werden Isoformen vom N2A-Typ (3,3-3,7 MDa), im Herzmuskel mehrere Isoformen vom N2BA-Typ (3,2-3,7 MDa) sowie eine steife und kurze Isoform N2B (3,0 MDa) ko-exprimiert. Das Verhältnis dieser Isoformen bestimmt zu einem großen Teil die elastischen Eigenschaften des Titinfilaments. Während der Embryonalentwicklung ändert sich das Verhältnis der verschiedenen Isoformen. Es findet eine verstärkte Expression kürzerer und somit steiferer Isoformen statt. Als Folge daraus sinkt die Elastizität des Titinfilaments. Doch welche Faktoren sind es, die diesen Isoformenswitch beeinflussen? Embryonale Rattenkardiomyozyten dienen uns zur Beantwortung dieser Frage als Zellkulturmodell. Nach hormoneller, bzw. medikamentöser Behandlung der Zellen vergleichen wir diese mit unbehandelten Kontrollzellen. So können wir Rückschlüsse auf die beteiligten Signalwege ziehen und die Regulation des Isoformenswitch näher beleuchten.
Die Isoformen können anhand ihrer Größe unterschieden werden. Die klassische SDS-PAGE stößt aufgrund der enormen Größe von Titin jedoch an ihre Grenzen. Deshalb verwenden wir hier eine angepasste Sonderform der SDS-PAGE.

