Die Feinjustierung der Elastizität von Titin
Der Isoformenswitch ist zwar ein dynamischer, aber zeitlich gesehen ein eher mittel- bis langfristig wirksamer Anpassungsprozess. Eine kurzfristige Feinjustierung der Elastizität ist über posttranslationale Modifikationen, insbesondere Phosphorylierungen möglich.
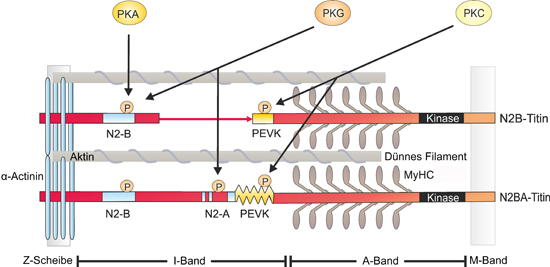
Krüger & Linke, Journal of Molecular and Cellular Cardiology 2009
Die für die Modulation der Elastizität verantwortlichen Phosphorylierungsstellen liegen in den beiden elastischen I-Band-Regionen N2-B und PEVK. Erstaunlicherweise nimmt die Elastizität bei Phosphorylierung der N2B-Domäne zu, während die Phosphorylierung der PEVK-Region zu einer Abnahme der Elastizität führt. Bislang sind als beteiligte Kinasen unter anderem die cAMP-abhängige Proteinkinase (PKA), die cGMP-abhängige Proteinkinase (PKG) und die Ca2+-abhängige Proteinkinase (PKCα) bekannt.
Der Fokus unserer Forschung liegt bei diesem Projekt auf folgenden Aspekten: Welche Proteinkinasen phosphorylieren Titins elastische Domänen? An welcher Position genau findet die Phosphorylierung statt? Ändert sich der Phosphorylierungsstatus des Titinfilaments unter pathologischen Bedingungen, insbesondere bei Herzmuskelerkrankungen? Führt der knock out einzelner Gene zu einem veränderten Phosphorylierungslevel?
Patienten mit Typ 2 Diabetes Mellitus weisen im Herzen eine gestörte Insulinhomöostase auf. Die Folge dessen kann eine gestörte Regulation der Titin-Phosphorylierung sein. In Kooperation mit PD Dr. Wilhelm Röll von der Friedrich-Wilhelms-Universität Bonn untersuchen wir deshalb sowohl den Phosphorylierungsstatus als auch die elastischen Eigenschaften des Titinfilaments betroffener Patienten.
Dabei weisen wir die Phosphorylierungen über Western-blotting nach. Zusätzlich liefert uns die Kraftmikroskopie Aussagen über Änderungen in der Elastizität des Titinfilaments.
Bei all diesen Fragestellungen untersuchen wir zudem biochemisch die zugehörigen Proteinkinasesignalwege, um aufzuschlüsseln, an welchen Stellen der Signaltransduktion Veränderungen stattfinden.

