Kraftmikroskopie
Kraftmessungen am isolierten gehäuteten skeletalen oder kardialen Myozyten:
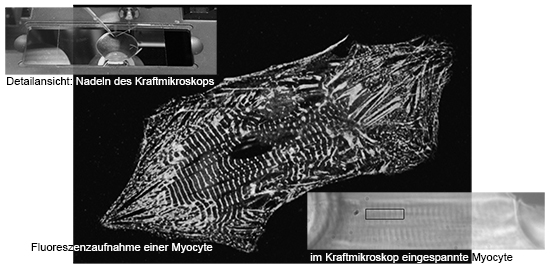
Die Elastitzität bzw. die passive Steifigkeit von Herzmuskelzellen kann mittels Kraftmessungen verfolgt werden.
Hierfür werden Detergenz-behandelte, gehäutete Einzelmyozyten zwischen zwei Nadeln angeklebt, die mit einem Kraftsensor und einem Längengeber verbunden sind. Dies findet in Ca2+-freier Lösung statt, um eine aktive Kontraktion der Zelle zu verhindern. Die Zelle wird in einem definierten Programm schrittweise gedehnt und die dabei wirkenden Kräfte gemessen. Durch eine angeschlossene Kamera kann die Sarkomerlänge bestimmt und die Kräfte den jeweiligen Sarkomerlängen zugeordnet werden. Herzkrankheiten führen oft zu einer im Vergleich zum gesunden Herz veränderten Elastizität.
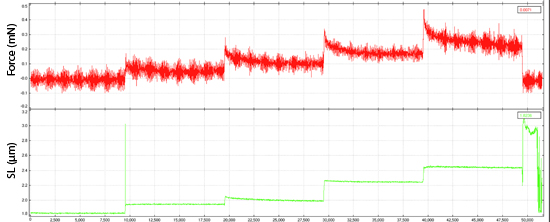
Exemplarisches Ergebnis einer Kraftmessung. (SL = Sarkomer-Länge)
Biochemische Analyse von Titin
 SDS-Polyacrylamid-Gelelektrophorese:
SDS-Polyacrylamid-Gelelektrophorese:
Aufgrund seiner Größe ist es zur elektrophoretischen Auftrennung von Titin nötig das klassische Protokoll zur Herstellung der SDS-Gele zu modifizieren. Die verwendeten Gele enthalten 1,8-2,2% Polyacrylmid und werden zusätzlich durch 0,5% Agarose verstärkt. Die Elektrophorese läuft bei niedriger Stromstärke und üblicherweise über Nacht ab.
Western-blotting:
Auch beim Transfer auf eine PVDF-Membran muss die enorme Größe Titins beachtet werden. Bei Verwendung eines Fast-Blot Systems wird eine Stromstärke von 1,5-2,5 Ampere für 15-30 h angelegt.
Weitere Standardmethoden
- Fluoreszenzmikroskopie
- Biochemie:
- Elektrophorese; SDS-PAGE
- Western Blotting
- Molekularbiologie:
- PCR
- Klonierung
- Agarosegelelektrophorese
- Proteinreinigung:
- Expression von Proteinen in E. coli
- Affinitätsreinigung
- Größenausschlusschromatographie
- Ionenaustauschchromatographie
- Zellkulturen:
- Embryonale Rattenkardiomyozyten
- Adulte Rattenkardiomyozyten
- Zelllinien (HEK, COS-7, C2C12)

